Журнал СЕМЕЙНАЯ МЕДИЦИНА №1 (63), 2016
Т. И. Насонова, И. В. Сазонов, А. Ю. Гончар, Т. В. Колосова, Т.М. Рябиченко, Ю.И. Головченко
Национальная медицинская академия последипломного образования им. П.Л. Шупика, г. Киев Киевская городская клиническая больница №9, г. Киев
Резюме. В статье представлены результаты исследования 50 пациентов с хронической ишемией мозга (дисциркуляторная энцефалопатия) на фоне метаболического синдрома (МС) в возрасте от 37 до 78 лет. 30 пациентов – основная группа – принимали в составе комплексной терапии препарат Ноофен®. 20 пациентов – контрольная группа – в состав терапии Ноофен® не включался. Применение Ноофена у пациентов, страдающих хронической ишемией мозга, показало его положительное влияние на восстановление неврологического дефицита, когнитивные функции и эмоциональное состояние пациентов. Установлена хорошая переносимость Ноофена, отсутствие существенных побочных эффектов при его комбинации с другими лекарственными средствами. Лечение Ноофеном больных с МС приводит к существенному клиническому улучшению, а также снижает степень прогрессирования заболевания.
Ключевые слова: хроническая ишемия мозга, дисциркуляторная энцефалопатия, метаболический синдром, Ноофен®.
Интерес к проблеме цереброваскулярных заболеваний обусловлен высоким потенциалом их инвалидизации, ростом смертности среди людей молодого возраста, а также прогрессированием когнитивных нарушений. В этой связи вопросы профилактики, лечения и реабилитации ишемии мозга являются первостепенными и вызывают интерес врачей-интернистов всего мира.
Если вопросами острой ишемии мозга обеспокоены ученые различных направлений: физиологи, биохимики, реаниматологи и неврологи, то хронической ишемии уделяется не столь весомое значение. Однако, не следует забывать, что с одной стороны постарение населения планеты, которое обусловлено снижением рождаемости и увеличением факторов риска цереброваскулярных заболеваний, а с другой стороны увеличение доли лиц молодого возраста в структуре церебральной ишемии в значительной степени оставляют актуальными вопросы профилактики и лечения хронической ишемии мозга. Пожилой возраст, как фактор риска цереброваскулярных заболеваний в последние годы пересматривается. Согласно результатам недавнего исследования по инсульту, проведенного в США (Greater Cincinnati / Northern Kentucky Stroke Study – GCNKSS) в сообществе численностью 1,3 млн человек, доля инсульта у лиц в возрасте от 20 до 54 лет за период с 1993-1994 гг. до 2005 г. увеличилась с 13 до 19%, а средний возраст пациентов с впервые развившимся инсультом уменьшился с 71 года в 1993-1994 гг. до 69 лет в 2005 г. [1]. Вероятным объяснением данного факта является изменение демографических характеристик причинных факторов риска развития инсульта – например, рост распространенности ожирения у детей и молодых взрослых, малоподвижного образа жизни и нездорового питания, которые могут обусловливать преждевременное развитие сосудистых заболеваний в результате повышения артериального давления и развития сахарного диабета. Согласно данным Национального исследования состояния здоровья и образа питания населения США (NHNHS), распространенность факторов риска развития инсультов в США среди взрослых в возрасте от 20 до 54 лет возросла практически в 2 раза: распространенность сахарного диабета повысилась с 2% в 1988-1994 гг. до 4% в 2005-2006 гг., высоких показателей холестерина с 11 до 21%, а ожирения с 19 до 34%[1].
В 1988 г. G. Reaven предложил термин – «синдром Х», или метаболический синдром (МС), который включал гиперинсулинемию, нарушение толерантности к глюкозе, инсулинорезистентность, повышение холестерина липопротеидов низкой плотности, низкий уровень холестерина липопротеидов высокой плотности, артериальную гипертензию (АГ). В 1989 г. N.M. Kaplan назвал этот синдром «смертельным квартетом», или синдромом инсулинорезистентности, и объединил в его составе андроидное ожирение, нарушение толерантности к глюкозе, гиперинсулинемию, артериальную гипертензию. Такое название МС получил благодаря тому, что при данном состоянии увеличивается риск потенциально смертельных заболеваний, связанных с атеросклерозом.
Классический вариант МС представляет собой сочетание АГ, абдоминального ожирения с нарушением липидного спектра и нарушением толерантности к глюкозе (и/или высокой гликемией натощак). Эти пациенты имеют очень высокий риск сердечно-сосудистых заболеваний, вероятность развития сахарного диабета в ближайшие 5-7 лет также является высокой. Таким образом, неудивительно, что у больных с МС при одновременном наличии указанных факторов риска значительно увеличивается риск развития таких заболеваний, как ишемическая болезнь сердца, инсульт и окклюзия артерий.
Проблема клинических проявлений и осложнений МС изучена недостаточно. В 2006 г. Американские Ассоциации Сердца и Инсульта (АНА и АSА) идентифицировали МС как наименее документированный потенциально модифицируемый фактор риска ишемического инсульта [4].
Практически все исследования свидетельствуют о крайне высоком суммарном риске МС, его фатальной роли в ускорении развития сердечно-сосудистых и цереброваскулярных заболеваний. В связи с этим представляется актуальной дальнейшая разработка комплексного лечения составляющих МС в клинической практике [3].
При приеме пациента с МС у врача часто возникает необходимость в коррекции не только соматических компонентов данного симптомокомплекса, но нередко и сопутствующих МС расстройств настроения, тревоги.
Вероятными механизмами связи состояния тревоги и МС могут быть нарушения вегетативной нервной системы, гипоталамо–гипофизарно-адреналовой регуляции, повышение уровней маркеров воспаления и гемостаза, а также склонность к нездоровому образу жизни (курение, переедание).
Тревога – это универсальный психофизиологический феномен, связанный с реакцией на стрессовый раздражитель. Эмоциональные реакции происходят при участии g–аминомасляной кислоты бензодиазепинового рецепторного комплекса (ГАМК–бензодиазепиновый комплекс). Именно этот комплекс формирует процессы торможения, и от него зависит, насколько выражена реакция страха. ГАМК взаимодействует со своим рецептором, способствует открытию хлорного канала, ионы хлора проникают в клетку, и за счет этого возникает процесс торможения. Если комплекс работает без сбоя, эти процессы уравновешены, а при разных нарушениях баланса ГАМК недостаточно взаимодействует с рецепторами, ионы хлора неадекватно входят в клетку, возникают тревога и страх [2]. Патопсихологические симптомы могут нарушать способность пациентов соблюдать режимы лечения и следовать рекомендациям врачей для снижения риска сердечно-сосудистых осложнений. Общая тревожность, по заключению ряда авторов, ассоциируется со снижением хорошей переносимости антигипертензивных препаратов.
В литературе встречаются противоречивые данные о влиянии МС на когнитивные нарушения. M.G. Dik и соавторы выявили вероятную связь между МС и значительным снижением когнитивных функций у больных, особенно скорости обработки информации [5]. В исследовании N.M. Gatto и соавт. Выявлено, что больные с МС без сахарного диабета хуже исполняли когнитивные тесты, оценивающие функцию вербальной и семантической памяти, в сравнении с пациентами без МС. С другой стороны, результаты проспективных исследований свидетельствуют, что наличие сахарного диабета достоверно повышает частоту сосудистых когнитивных нарушений, особенно сосудистой деменции, у больных [5]. В некоторых исследованиях показано повышенный риск развития умеренных когнитивных нарушений и болезни Альцгеймера у пациентов с повышенным систолическим давлением [6].
Среди препаратов, обладающих антигипоксическим, антиамнестическим и транквилизирующим действием на фармацевтическом рынке Украины особого внимания заслуживает Ноофен® (производитель Олайнфарма). Ноофен® является производным ГАМК и фенилэтиламина (γ-амино-β-фенилмасляной кислоты гидрохлорид). Доминирующим является его антигипоксическое и антиамнестическое действие. Ноофен® стимулирует процессы обучения, улучшает память, повышает физическую и умственную деятельность. Также Ноофен® обладает транквилизирующими особенностями: устраняет психоэмоциональное напряжение, тревожность, страх, эмоциональную лабильность, раздражительность, улучшает сон; удлиняет и усиливает действие снотворных, наркотических, нейролептических и противосудорожных средств. В отличие от транквилизаторов, под влиянием Ноофена улучшаются показатели высшей нервной деятельности (внимание, память, скорость и точность сенсорно-моторных реакций). Выпускается Ноофен® в форме капсул 250 мг, таблеток 250 мг и порошка 100 мг и 500 мг. Подобное сочетание позволяет:
1) максимально индивидуализировать лечение больных с МС в зависимости от состояния больного, особенностей сопутствующей фармакотерапии;
2) эффективно комбинировать различные дозовые режимы и схемы;
3) обеспечивать комплайенс в процессе лечения.
Ноофен® выпускается в полном соответствии с европейскими критериями качества и одновременно является одним из наиболее доступных препаратов в Украине, что существенно расширяет возможности и перспективы его применения в отечественной клинической практике.
В настоящем исследовании была предпринята попытка изучить эффективность Ноофена при хронической ишемии мозга у больных с МС в аспекте его влияния на выраженность неврологических проявлений, тревогу, депрессию и когнитивные функции.
Целью исследования явился анализ эффективности лечения больных хронической ишемией мозга на фоне МС с использованием препарата Ноофен®. В задачи работы входило: изучение клинической эффективности и безопасности Ноофен® у больных основной группы в сравнении с контрольной. Особенностью работы было выявление особенностей прогрессирования хронической ишемии у больных основной и контрольной групп.
Материалы и методы
Наблюдали 50 пациентов с хронической ишемией мозга (дисциркуляторная энцефалопатия) на фоне МС в возрасте от 37 до 78 лет. 30 пациентов – основная группа – принимали в составе комплексной терапии Ноофен®. 20 пациентов – контрольная группа – в состав терапии Ноофен® не включался.
Пациенты исследуемых групп наблюдались в течение 28 дней. Они были осмотрены до начала лечения, затем через 2 недели – контрольный осмотр и в конце месяца. Исследование проводилось открыто. При наборе пациентов использовали метод рандомизации. Пациенты как основной, так и контрольной групп получали базовую терапию, которая была максимально унифицирована и включала прием диуретиков, гипотензивных, антиагрегантных, и липидоснижающих препаратов. Препараты и дозы назначались индивидуально, с учетом показателей артериального давления, липидограммы, наличием сопутствующих заболеваний. Особое место в лечении занимала коррекция артериального давления и приближалась к 120/140 - 70/80 мм рт. ст. Ноофен® назначался перорально в суточной дозе 250 мг 3 раза/сут. в течение 28 дней после еды. В группу контроля вошли 20 пациентов, получавшие традиционную терапию без использования Ноофена. Основная и контрольная группы были сопоставимы по полу, возрасту, этиологии, выраженности составляющих МС и тяжести течения болезни.
Больным проводилось клинико-неврологическое обследование (жалобы, анамнез, неврологический статус), исследование сердечно-сосудистой системы, измерение артериального давления, ЭКГ, холтеровское мониторирование, суточное регистрирование артериального давления, определение показателей общего анализа крови, мочи, глюкозы крови, гемокоагуляционных показателей, коэффициент атерогенности, СРБ, билирубина, АЛТ, АСТ, общего холестерина, триглицеридов, липопротеидов низкой, высокой плотности и гликозилированного гемоглобина HbA1с. Лабораторные и инструментальные исследования проводились до и после лечения (день -1 и день 28).
Пациентам также определялись антропометрические показатели: вес в кг, рост в метрах, окружность талии и бедер, высчитывался индекс массы тела.
Всем пациентам проводили исследование когнитивных вызванных потенциалов методом Р300. Исследование выполнено на аппарате «Нейрон-спектр-5». Использовалась бинауральная стимуляция.
Электроды, которые использовались при исследовании:
- заземляющий электрод Fpz;
- С3 и С4 отведения, в которых регистрировался ответ;
- референтные электроды А1 и А2.
Всего было выполнено 100 усреднений, из которых 20% составляли значимые стимулы, 80% незначимые стимулы. Частота стимуляции 1 Гц, фильтр 0,5-75 Гц. Значимые стимулы были в виде щелчков, имели длительность 5 мс, частоту 1000 Гц, громкость 100 дБ. Незначимые стимулы воспроизводились в виде тона, имели громкость 80 дБ, частоту 1000 Гц, имели длительность 100 мс. Во время исследования была измерена латентность и амплитуда волны Р3.
Нейропсихологическое тестирование включало:
- скрининг-оценка психического состояния по шкале MMSE;
- Монреальская шкала оценки когнитивных функций МоСА;
- шкала тревоги и депрессии Гамильтона;
- шкала депрессии Бека;
- исследование внимания: поиск чисел по таблицам Шульте с оценкой времени выполнения задания.
Ввиду разномасштабности и разнонаправленности использованных шкал для удобства изложения и восприятия материала мы сочли удобным описывать динамику бальной оценки упомянутых шкал в относительных процентах, говоря о проценте улучшения/ухудшения соответствующего показателя по отношению к его исходному значению.
Всем больным однократно проводилась магнитно-резонансная томография головного мозга, а также ультразвуковое исследование сосудов головы и шеи. На МРТ определяли размеры очагов, количество кист, размеры боковых желудочков, конвекситальных борозд, гиппокампа. При оценке размеров очагов поражения использовали классификацию НИИ неврологии РАМН 2003 г [7]: лакунарные (до 10 мм), мелкие (10-15 мм), средние очаги (10-50 мм), большие (больше 50 мм).
Оценка эффективности терапии проводилась по 5-бальной системе, переносимости препарата – по 4-бальной системе.
У всех пациентов был определен МС согласно критериев IDF.
В немедикаментозной и медикаментозной коррекции компонентов МС предпочтителен комплексный подход воздействия одновременно на 2–3 фактора.
Пациентам с МС наряду с изменением образа жизни и питания показано применение антигипертензивных (например, ингибиторы АПФ), гиполипидемических (если преобладает гиперхолестеринемия – статины, если преобладает гипертриглицеридемия – фибраты) и гипогликемических препаратов.
Статистическая обработка результатов исследования проводилась с помощью современных методов математического анализа с использованием пакета статистических программ «Statistica-6» и «Exel 2003». Рассчитывались средние показатели и ошибки средних. В качестве критерия достоверности отклонения показателей использовали параметрический критерий Стьюдента и непараметрический критерий U (Вилкоксона-Манна-Уитни).
Результаты исследования и их обсуждения
Клинические характеристики больных основной и контрольной групп представлены в табл.
Таблица Основные клинические характеристики пациентов
|
Показатель |
Основная группа |
Контрольная группа |
Р |
|
Возраст больных |
51,8 (5,8) |
51,6 (5,8) |
0,767 |
|
Курильщики % |
31,5 |
24,1 |
0,108 |
|
Глюкоза крови |
4,84 (0,44) |
4,57 (0,57) |
<0,001 |
|
Общий холестерин (ммоль/л) |
5,77 (1,0) |
5,14 (0,98) |
<0,001 |
|
ЛПНП (ммоль/л) |
3,92 (0,95) |
3,10 (0,94) |
0,079 |
|
ЛПВП (ммоль/л) |
1,34 (0,28) |
1,36 (0,20) |
<0,001 |
|
Триглицериди (ммоль/л) |
1,15 (0,57) |
1,35 (1,35) |
<0,001 |
|
Фибриноген (г/л) |
2,95 (0,56) |
3,02 (0,51) |
0,183 |
|
Систолическое АД (мм рт.ст) |
139,0 (15,8) |
139,8 (12,4) |
<0,001 |
|
Диастолическое АД (мм рт.ст) |
87,8 (10,2) |
94,8 (8,7) |
<0,001 |
Все пациенты основной и контрольной групп страдали артериальной гипертензией, по данным лабораторных исследований имели инсулинорезистентность, либо сахарный диабет со стажем от нескольких месяцев до 15 лет, атерогенна дислипопротеинемия у 24 больных (48%) была выявлена нами впервые.
У больных обеих групп выявлено нарушение липидного обмена, повышение уровней ОХС та ХС ЛПНП и ТГ (5,14 + 0,98 ммоль/л, 4,10 + 0,94 ммоль/л и 2,35 + 1,35) (5,77 + 1,0 ммоль/л, 3,92 + 0,95 ммоль/л, 1,15 + 0,57 ммоль/л).
Анализ клинико-неврологических проявлений показал, что у больных обеих групп наиболее часто встречались вестибулярноатактический, пирамидный, психопатологический (когнитивные нарушения, тревога, депрессия) синдромы. Вестибулярно-атактические нарушения нами были выявлены у 27 (54%) больных основной группы и 18 (46,4%) – в группе сравнения. Пирамидный синдром от умеренной рефлекторной недостаточности до парезов встречался у 23 (90%) больных основной группы и 12 (60%) – в группе контроля.
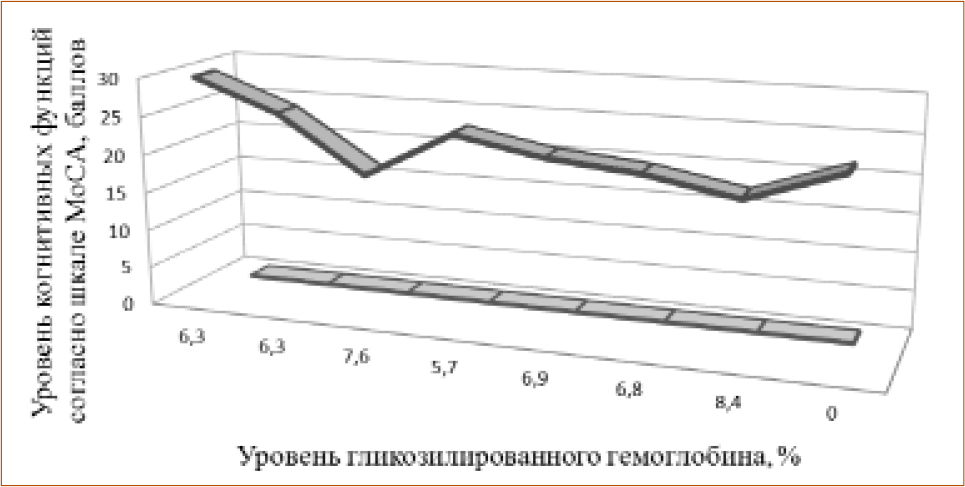
Рисунок 1 Зависимость уровня когнитивных функций от уровня гликозилированного гемоглобина до начала лечения (р<0,05)
Когнитивные нарушения (легкие и умеренные) определялись у 48 больных (96%), признаки тревоги и депрессии определялись в большей или меньшей степени у 50 больных (100%). Когнитивные нарушения проявлялись в снижении памяти, в том числе профессиональной, нарушении внимания, замедлении психических процессов, а также ограничении способностей к планированию и контролю. Эмоционально-личностные расстройства проявлялись в эмоциональной лабильности, депрессии, снижении критики.
Уже при первичном обследовании и было выявлено корреляционную связь между повышением показателя гликозилированного гемоглобина и снижением показателей когнитивных функций по шкале МоСА (рис. 1), изменение психической истощаемости по шкалам Шульте и устойчивостью внимания согласно корректурной пробы у больных обеих групп до лечения (индекс корреляции R=0,85), а также признаками тревоги.
Несмотря на то, что доля больных, имеющих в анамнезе подтвержденный сахарный диабет была небольшой (4 больных из 50) корреляционная связь, которая была выявлена свидетельствует о том, что когнитивные функции снижаются у больных при наличии только инсулинорезистентности и без сахарного диабета. Понимая, что на когнитивные функции могут влиять и другие компоненты МС (артериальная гипертензия, повышение уровней липидов, анамнез заболевания и др.) мы выделили группу больных с идентичными показателями АД, анамнеза заболевания, липидного спектра, исключили больных с сахарным диабетом и получили аналогичную корреляционную связь.
В результате проведенного лечения состояние больных обеих групп улучшилось. Уже в период контрольного осмотра (через 2 недели после начала лечения) у пациентов основной группы уменьшилась головная боль, головокружение, шаткость при ходьбе, тревожные проявления, улучшился сон, настроение. Эти показатели достигли статистически достоверных данных (р<0,05) на 28 день.
Сравнительный анализ неврологической симптоматики показал достоверные изменения показателей пирамидной недостаточности, вестибулопатии, астении во время контрольного обследования (р<0,05), преимущественно у больных в комплексное лечение которых был включен Ноофен®.
Анализ показателей нейропсихологического тестирования продемонстрировал значительное улучшение когнитивного статуса в основной группе к 28 дню от начала лечения: достоверно снизились часовые показатели таблицы Шульте, повысилась разговорная активность, увеличился объем запоминания слов, улучшились показатели когнитивных функций по шкалам MMSE и MoCA (рис. 2, 3). В контрольной группе восстановление интеллектуально-мнестических функций было замедлено и не достигло такой разницы между начальной и конечной точками, как у больных основной группы (р<0,05). Положительная динамика когнитивных функций у пациентов в контрольной группе в определенной степени могла быть связана с нормализацией у них артериального давления, спонтанным улучшением когнитивных функций и определенным опытом в решении нейропсихологических тестов.
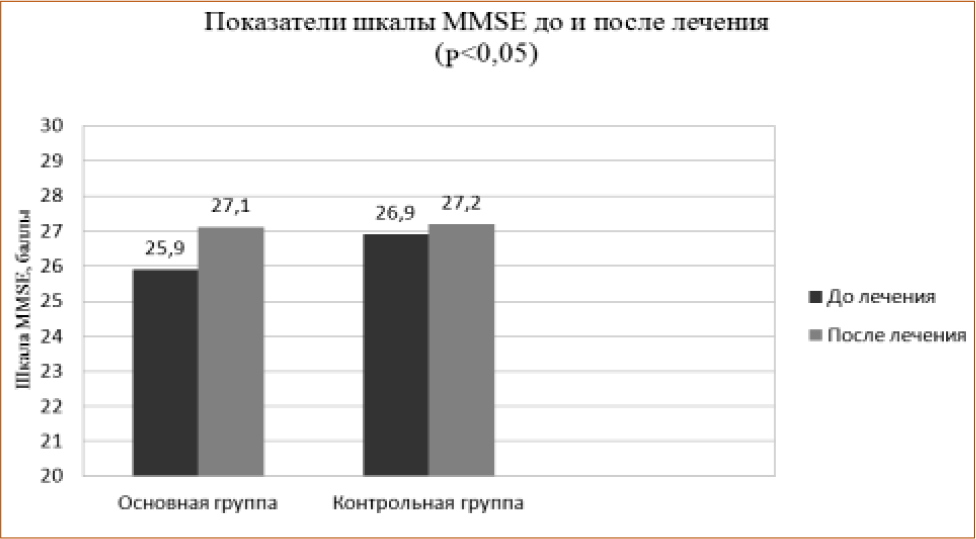
Рисунок 2 Показатели когнитивных функций по шкалам MMSE и MoCA
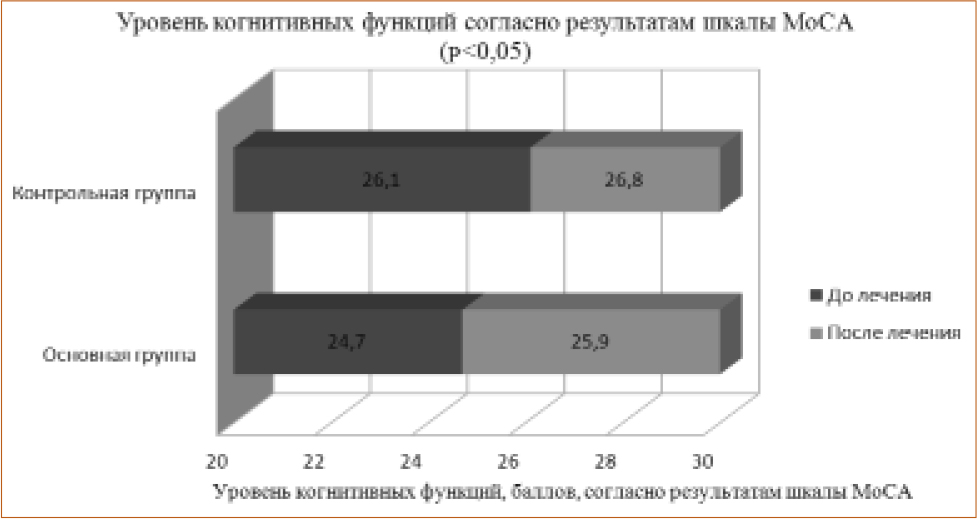
Рисунок 3 Показатели когнитивных функций по шкалам MMSE и MoCA
Анализ результатов вызванных когнитивных потенциалов показал следующее.
До приема препарата средняя латентность волны Р3 в опытной группе составляла 320 мс, 325 мс в контрольной группе. Соответственно, амплитуда Р3 волны в опытной группе в среднем составляла 8,2 мкв, в контрольной группе в среднем составляла 8,5 мкв.
При повторном проведении исследования, которое было выполнено после 28-суточного приема препарата Ноофен® отмечались следующие показатели:
- в опытной группе было зарегистрировано уменьшение средней латентности Р3 волны до 310 мс;
- в контрольной группе, наоборот, было зарегистрировано некоторое увеличение средней латентности волны Р3 до 335 мс;
- амплитуда волны Р3 в опытной группе при повторном исследовании в среднем увеличилась до значения 9,4 мкв;
- в контрольной группе амплитуда волны Р3 при повторном исследовании существенным образом не изменилась, осталась на прежнем уровне – 8,5 мкв.
Увеличение амплитуды Р3 волны и уменьшение ее латентности свидетельствует о положительном влиянии на когнитивные функции препарата Ноофен®.
Особенностью терапевтического влияния Ноофен® определялась редукция значительного количества висцерально-вегетативных проявлений тревожных расстройств: пациенты уже на 14 день отмечали улучшение дыхания, более стабильные показатели артериального давления, пульса, уменьшения боли в мышцах, уменьшение потливости, головокружения, уменьшение потребности в еде. Кроме того, пациенты отмечали улучшение работоспособности за счет повышения качества когнитивных функций (внимания, памяти).
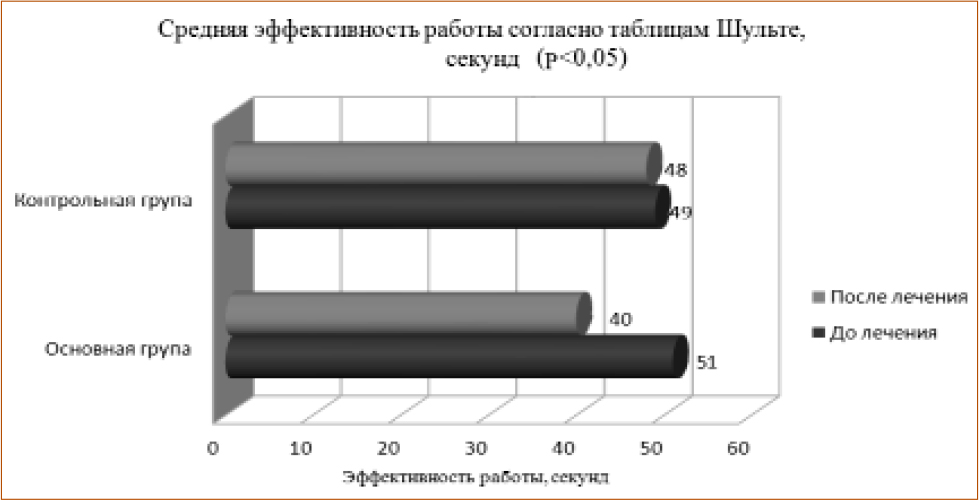
Рисунок 4 Средняя эффективность работы по таблицам Шульте
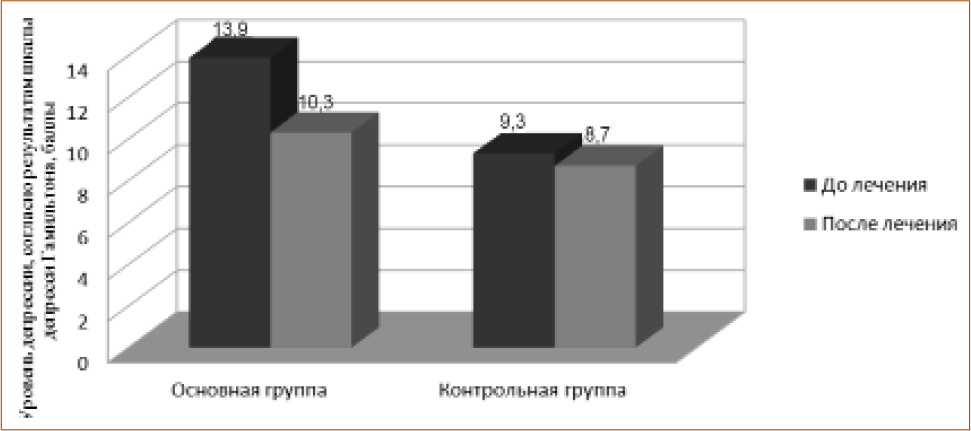
Рисунок 5 Уровень депрессии по шкале Бека
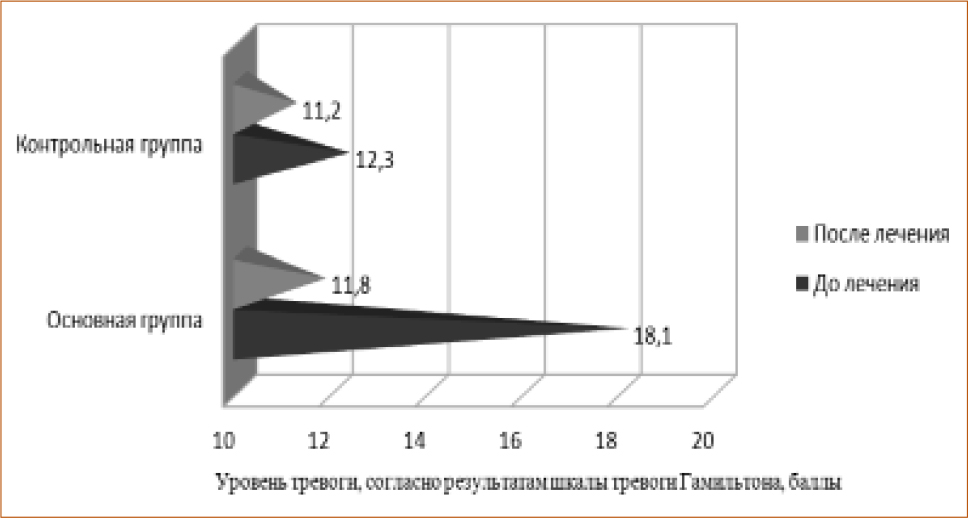
Рисунок 6 Уровень тревоги по шкале Гамильтона
Ноофен® зарекомендовал себя как безопасный препарат при лечении больных с хронической ишемией мозга и признаками МС. Результаты применения Ноофена у пациентов показали хорошую переносимость лекарственного средства, отсутствие существенных побочных эффектов при его комбинации с антигипертензивными, антитромбоцитарными средствами и статинами, которые используются у пациентов с целью профилактики острого нарушения мозгового кровообращения и других сердечно-сосудистых заболеваний. В основной группе (30 человек) у больных, получавших Ноофен® побочные эффекты зафиксированы у 2 пациентов (4%), которые были представлены в виде желудочно-кишечных расстройств (тошнота и сухость во рту). Пациенты после консультаций решили продолжить лечение. Все 30 человек, вошедшие в исследуемую группу, оценили результаты лечения как «положительные»: 18 больных как «отличные», 11 как «хорошие» и 1 пациент как «удовлетворительные».
Эффективность терапии была оценена врачом в основной группе – 3,8 балла и в контрольной группе – 3,4 балла.
Выводы
- Применение препарата Ноофен® у пациентов, страдающих хронической ишемией мозга показало его положительное влияние на восстановление неврологического дефицита, когнитивные функции и эмоциональное состояние пациентов.
- Установлена хорошая переносимость Ноофена, отсутствие существенных побочных эффектов при его комбинации с другими лекарственными средствами, которые используются для лечения и профилактики хронической ишемии мозга, а также составляющих компонентов МС (артериальной гипертензии и др.)
- Лечение Ноофеном больных с МС приводит к существенному клиническому улучшению, а также снижает степень прогрессирования заболевания.
- Ноофен® можно рекомендовать больным с признаками МС для коррекции когнитивного дефицита, эмоционально-волевых нарушений на различных стадиях лечения хронической ишемии мозга.
Список использованной литературы
1. The Lancet Neurol. - 2012. - Vol.11 (12). - Р. 1013
2. Davies S.J., Jackson P.R., Ramsay L.E., Ghahramani P. Drug intolerance due to nonspecific adverse effects related to psychiatric morbidity in hypertensive patients.// Arch Intern Med. - 2003. - Vol.163. - Р. 592-600.
3. Перова Н.В., Мамедов М.Н., Метельская В.А. Кластер факторов высокого риска сердечно–сосудистых заболеваний: метаболический синдром.// Междунар.
Мед. Журнал. - 1999. - №2. - С. 21-24.
4. Golgstein L.B., Adams R., Alberts M.J. et al. Primary prevention of Ische mic Stroke: guideline from the American Heart Association. Circulation. - 2006. - Vol.113. - Р. e873-e923.
5. Копчак О.О. Особливості когнітивних порушень у хворих із метаболічним синдромом.// Міжнародний неврологічний журнал. – 2011. - №5, 2011. - Р. 70-75.
6. Raffaitin C., Gin H. et al. Metabolic Syndrome and Risk for Incident Alzheimer’s Disease or Vascular Dementia // Diabetes Care. - 2009. - Vol.32. -P. 169-174.
7. Новик А.А. Руководство по исследованию качества жизни в медицине / Новик А.А., Ионова Т.И. - М.: Олма Медиа Групп, 2007. - 320 с.
Надійшла до редакції 19.11.2014 р.
CHRONIC CEREBRAL ISCHEMIA AND METABOLIC SYNDROME
T.I. Nasonova, I.V. Sazonov, A.Yu. Gonchar, T.V. Kolosova, T.M. Riabichenko, Yu.I. Golovchenko
Summary
The article presents the results of a study of 50 patients with chronic cerebral ischemia (discirculatory encephalopathy) and metabolic syndrome (MS) aged 37 to 78 years. 30 patients (index group) took the drug Noofen® as a component of the complex therapy. In 20 patients (control group), Noofen® was not included. The application of Noofen in patients suffering from chronic cerebral ischemia showed a positive effect on recovery of neurological deficits, cognitive functions, and emotional state of the patients. It was found that Noofen was well tolerated and had no significant side effects when combined with other drugs. Noofen treatment of patients with MS led to significant clinical improvement and reduced the extent of disease progression.

